口罩產品驗證
主要國家和地區法規
在本指南中,我們涵蓋了口罩和呼吸器標準的基礎知識,FDA要求,標籤要求,實驗室測試等。
提及的產品
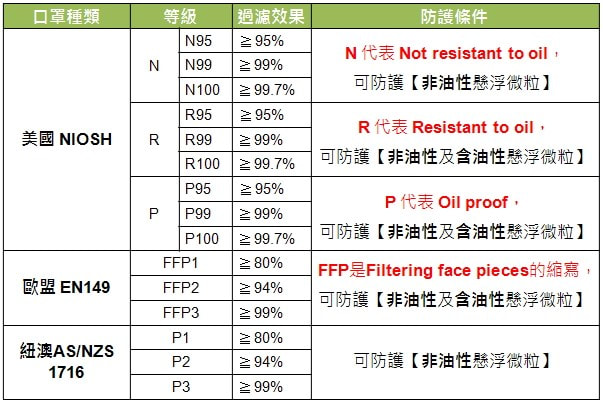
過濾能力分類
在閱讀本指南之前,請注意以下幾種口罩和呼吸器的類型(及其各自的過濾能力):
1. N95,N99,N100標準:由美國國家職業安全與健康研究院(NIOSH)
2. FFP1,FFP2,FFP3標準:由歐洲標準委員會(CEN)維護
3. KN95:由中華人民共和國國家品質監督檢驗檢疫總局
COVID-19美國因口罩短缺的FDA豁免
由於目前的情況,FDA目前正在接受未經NIOSH批准但已獲得歐盟,中國,日本,韓國,墨西哥,澳大利亞或巴西當局批准的進口N95口罩。 510(k)口罩的上市前通知也已放寬。請注意,這情況隨時可能更改。
外科口罩和呼吸器:21 CFR(FDA)
在美國銷售的外科口罩受21 CFR 878.4040的監管。 根據FDA提供的定義 ,
外科口罩定義為保護佩戴者和患者免受微生物,體液等的侵害。
FDA為外科口罩設定要求並提供指導,包括:
外科口罩(包括隔離口罩,手術口罩和牙科口罩)被FDA歸類為 II裝置。對於這些設備,製造商或進口商在將產品投放市場之前,必須提交501(k)通知並獲得FDA批准。
510(k) 通知的提交應在產品投放美國市場之前90天完成。此外,提交者必須提供與其設備和類似市場設備的比較表。
在此,我們提供一份510(k) 通知的摘要:
口罩的進口商可以在FDA官方網站上找到510(k)通知的教學文件。
在以下各節中,我們簡要描述了主要要求。
請注意,如果手術用的N95呼吸器獲得NIOSH(國家職業安全與健康研究所)的批准,並且與用戶皮膚接觸的成分具有生物相容性,則免於510(k)通知。
設備說明
FDA建議提供您要導入的口罩的說明,包括與已獲批准的類似設備進行比較。這種比較應包括以下資訊:
流體阻力
對於外科口罩,流體阻力對於防止感染的血液和其他體液的傳播至關重要。口罩必須根據ASTM F1862標準對手術口罩的流體阻力進行測試。
ASTM F1862提供了針對液體滲透阻力的標準測試方法。少量合成血液(約2 mL)用於以不同速度(80 mmHg,120 mmHg和160 mmHg)測試面罩。
過濾功效(BFE+PFE)
經常看到在美國銷售的N95防毒面具,這表明該防毒面具已經過測試,可以過濾出95%以上的空氣中顆粒物。
對於未經NIOSH批准的手術口罩,FDA建議希望聲稱其口罩具有N95過濾能力的進口商應分別按照ASTM F2101和ASTM F1215進行細菌過濾(BFE)和顆粒過濾(PFE)的測試。
但是,如果您的口罩已經被NIOSH批准,則可以提交NIOSH證書。
細菌過濾效率(BFE)
BFE是針對3μm左右大小的生物氣溶膠,花粉或液滴的防護能力的度量。 BFE通常用防止顆粒通過(例如BFE≥95%)通過能力的百分比表示。
ASTM F2101提供了評估手術口罩BFE的標準測試方法。手術口罩應符合ASTM F2101,以符合FDA。此外,ASTM歸類三個不同級別具有不同BFE性能掩模如下所示:
顆粒過濾效率(PFE)
PFE是在1µm下防護較小顆粒的能力的度量。在面罩的包裝上找到PFE百分比也很常見。
ASTM F2299提供了測量手術口罩PFE的標準測試方法。與BFE相似,ASTM也將具有不同PFE的口罩分為3個等級:
壓差
對於未經NIOSH認證的N95的手術口罩,FDA還建議根據MIL-M-36945C 4.4.1.1.1的測量壓差,用於評估面罩對氣流的阻力。這種特性與面罩的透氣性和舒適性有關。
易燃性測試測試
外科口罩的易燃性也應該被測試。根據FDA提供的建議,進口商可以使用以下任何一種標準來確定口罩在可燃性方面是否符合標準:
標籤和警告
進口商還需要確保正確標記了口罩。該標籤應包括:
21 CFR 807.87 概述了標籤要求,而進口商可以在21 CFR 801中找到一般標籤規定。
另外,第3類易燃性外科口罩應包含警告標籤,說明該產品不符合16 CFR 1610,NFPA或CPSC易燃性標準,提醒用家口罩可能在高強度熱源或火源附近著火。
品質管制體系
手術口罩是FDA定義的II類設備,製造商應遵守良好生產規範(GMP)。 GMP規定了設施提供的設計,製造,包裝,標籤,存儲,安裝服務的要求。
外國製造商也有義務提供許可證或報告,以證明其符合品質管制體系。每個製造商還應在適當的時候保持品質體系,並符合的要求 21 CFR 820,該體系被認為類似於ISO13485。
註冊Register和列表Listing
提交口罩的510(k)通知時,您需要提供機構資訊及產品的註冊號。在進口之前,進口商或製造商還應使用FDA電子設備註冊和列出系統設備機構 網上平臺去提供以下資訊 :
防護口罩和呼吸器:OSHA
對於旨在用於防止由有害粉塵,煙霧,霧氣和其他有害氣體引起的職業病的呼吸器,OSHA(職業安全)和衛生總署)提供了確定一般規定 呼吸器合規要求的。
29 CFR 1910.134
在 29 CFR 1910.134中,呼吸器應根據不同類別實現最低過濾效率。例如,N95防毒面具應過濾掉至少95%的滲透物,而N99可以過濾掉至少99%的滲透物。
同樣,字母N,P和R表示防油性,如下所示:
NIOSH的要求
42 CFR Part 84 (Subpart K—Non-Powered Air-Purifying Particulate Respirators) 規定了呼吸器設備必須滿足下列的要求才能獲得NIOSH的批准,當中包括但不限於:
其他法規
加州法案 65 (CA Prop 65)
加州法案 65旨在限制大多數產品(包括個人防護設備)中有害化學物質的暴露。話雖如此,如果您打算在加利福尼亞州進口和銷售口罩,則應驗證產品中的受限物質,這可以由SGS和TUV等協力廠商公司來完成。
以下是受CA Prop 65限制的某些物質:
風險
某些用於製造口罩和呼吸器的合成材料可能含有過量的受限化學物質和重金屬。
原產國
在美國,必須在進口產品(包括口罩)上貼上原產國標籤。標籤應是永久性的,並在包裝上可見。此外,進口商應指示供應商標籤的位置。
示例
產品包裝
除口罩外,在進口到美國時,包裝也受到管制。美國許多州對包裝材料中使用的有害物質設置了限制。接下來是對這些包裝要求的簡要概述。
重金屬限制
包裝材料限制使用鎘,鉛,汞等重金屬。進口商不得在包裝中使用過多的重金屬。實際上,沒有多少供應商可以提供包裝的檢測報告,因此,協力廠商包裝檢測服務是驗證並遵守法規的唯一方法。
標籤要求
對於口罩產品,必須在包裝上提供符合性和產品資訊。進口商應在其包裝上列出所有適用的標準,過濾效率,合格標記和製造商的資訊。
袋窒息警告
袋窒息警告標籤文本對所有亞馬遜賣家和美國某些州都是強制性的。在本文中,我們解釋了有關創建警告標籤文件,風險和違規處罰的必知知識。
亞馬遜示例
警告:為避免窒息的危險,請將此塑膠袋遠離嬰兒和兒童。請勿在嬰兒床,床,馬車或遊戲圍欄中使用此包。這個包不是玩具。
亞馬遜口罩和呼吸器要求
亞馬遜對醫療設備有嚴格的要求。一般而言,供應商應在FDA註冊並由FDA批准在美國銷售的產品。此外,面罩產品必須貼有以下資訊的標籤:
在本指南中,我們涵蓋了口罩和呼吸器標準的基礎知識,FDA要求,標籤要求,實驗室測試等。
提及的產品
- 3層,4層和5層手術口罩
- N95,N99,N100口罩或呼吸器
- FFP1,FFP2,FFP3口罩和呼吸器
- KN95口罩或呼吸器
過濾能力分類
在閱讀本指南之前,請注意以下幾種口罩和呼吸器的類型(及其各自的過濾能力):
1. N95,N99,N100標準:由美國國家職業安全與健康研究院(NIOSH)
- N95:至少95%
- N99,FFP3:至少99%
- N100:至少99.97%
2. FFP1,FFP2,FFP3標準:由歐洲標準委員會(CEN)維護
- FFP1:至少80%
- FFP2:至少94%
- FFP3:至少99%
3. KN95:由中華人民共和國國家品質監督檢驗檢疫總局
- KN95:至少95%
COVID-19美國因口罩短缺的FDA豁免
由於目前的情況,FDA目前正在接受未經NIOSH批准但已獲得歐盟,中國,日本,韓國,墨西哥,澳大利亞或巴西當局批准的進口N95口罩。 510(k)口罩的上市前通知也已放寬。請注意,這情況隨時可能更改。
外科口罩和呼吸器:21 CFR(FDA)
在美國銷售的外科口罩受21 CFR 878.4040的監管。 根據FDA提供的定義 ,
外科口罩定義為保護佩戴者和患者免受微生物,體液等的侵害。
FDA為外科口罩設定要求並提供指導,包括:
- 定義
- 分類
- 非臨床和臨床性能
- 可用性性能
- 標籤要求
- 警告和注意事項
外科口罩(包括隔離口罩,手術口罩和牙科口罩)被FDA歸類為 II裝置。對於這些設備,製造商或進口商在將產品投放市場之前,必須提交501(k)通知並獲得FDA批准。
510(k) 通知的提交應在產品投放美國市場之前90天完成。此外,提交者必須提供與其設備和類似市場設備的比較表。
在此,我們提供一份510(k) 通知的摘要:
- 產品規格和尺寸
- 機構註冊號
- FDA之下的產品分類
- 與同類市場產品的生產比較
- 建議的標籤
- 註冊的人員聯繫
- 合規聲明
- 相關的測試報告
口罩的進口商可以在FDA官方網站上找到510(k)通知的教學文件。
在以下各節中,我們簡要描述了主要要求。
請注意,如果手術用的N95呼吸器獲得NIOSH(國家職業安全與健康研究所)的批准,並且與用戶皮膚接觸的成分具有生物相容性,則免於510(k)通知。
設備說明
FDA建議提供您要導入的口罩的說明,包括與已獲批准的類似設備進行比較。這種比較應包括以下資訊:
- 材料
- 尺寸
- 設計
- 其他相關特徵
流體阻力
對於外科口罩,流體阻力對於防止感染的血液和其他體液的傳播至關重要。口罩必須根據ASTM F1862標準對手術口罩的流體阻力進行測試。
ASTM F1862提供了針對液體滲透阻力的標準測試方法。少量合成血液(約2 mL)用於以不同速度(80 mmHg,120 mmHg和160 mmHg)測試面罩。
過濾功效(BFE+PFE)
經常看到在美國銷售的N95防毒面具,這表明該防毒面具已經過測試,可以過濾出95%以上的空氣中顆粒物。
對於未經NIOSH批准的手術口罩,FDA建議希望聲稱其口罩具有N95過濾能力的進口商應分別按照ASTM F2101和ASTM F1215進行細菌過濾(BFE)和顆粒過濾(PFE)的測試。
但是,如果您的口罩已經被NIOSH批准,則可以提交NIOSH證書。
細菌過濾效率(BFE)
BFE是針對3μm左右大小的生物氣溶膠,花粉或液滴的防護能力的度量。 BFE通常用防止顆粒通過(例如BFE≥95%)通過能力的百分比表示。
ASTM F2101提供了評估手術口罩BFE的標準測試方法。手術口罩應符合ASTM F2101,以符合FDA。此外,ASTM歸類三個不同級別具有不同BFE性能掩模如下所示:
- ASTM等級1外科手術口罩- BFE≥95%,流體阻力80 mmHg
- ASTM 2級外科手術口罩- BFE≥98%,流體阻力120 mmHg
- ASTM等級3外科口罩– BFE≥98%,耐流體性160 mmHg
顆粒過濾效率(PFE)
PFE是在1µm下防護較小顆粒的能力的度量。在面罩的包裝上找到PFE百分比也很常見。
ASTM F2299提供了測量手術口罩PFE的標準測試方法。與BFE相似,ASTM也將具有不同PFE的口罩分為3個等級:
- ASTM 1級手術口罩– PFE≥95%@0.1微米,耐流體性80 mmHg
- ASTM 2級手術口罩– PFE≥98%@0.1微米,流體阻力120 mmHg
- ASTM 3級手術口罩– PFE≥98%@0.1微米,流體阻力160 mmHg
壓差
對於未經NIOSH認證的N95的手術口罩,FDA還建議根據MIL-M-36945C 4.4.1.1.1的測量壓差,用於評估面罩對氣流的阻力。這種特性與面罩的透氣性和舒適性有關。
易燃性測試測試
外科口罩的易燃性也應該被測試。根據FDA提供的建議,進口商可以使用以下任何一種標準來確定口罩在可燃性方面是否符合標準:
- 16 CRF 1610 – Standard for the flammability of textile products
- NFPA standard 702 – Standard of flammability of wearing apparel
- UL 2154 – UL Standard for Safety Fire Tests of Surgical Fabrics
標籤和警告
進口商還需要確保正確標記了口罩。該標籤應包括:
- 廠商資訊
- 指定用途的產品
- 使用產品的方向
- 原產國標記
- 法規標記
21 CFR 807.87 概述了標籤要求,而進口商可以在21 CFR 801中找到一般標籤規定。
另外,第3類易燃性外科口罩應包含警告標籤,說明該產品不符合16 CFR 1610,NFPA或CPSC易燃性標準,提醒用家口罩可能在高強度熱源或火源附近著火。
品質管制體系
手術口罩是FDA定義的II類設備,製造商應遵守良好生產規範(GMP)。 GMP規定了設施提供的設計,製造,包裝,標籤,存儲,安裝服務的要求。
外國製造商也有義務提供許可證或報告,以證明其符合品質管制體系。每個製造商還應在適當的時候保持品質體系,並符合的要求 21 CFR 820,該體系被認為類似於ISO13485。
註冊Register和列表Listing
提交口罩的510(k)通知時,您需要提供機構資訊及產品的註冊號。在進口之前,進口商或製造商還應使用FDA電子設備註冊和列出系統設備機構 網上平臺去提供以下資訊 :
- 設備機構的聯繫
- 網站地址(如果適用)
- 持有者的聯繫
- 官方聯繫機構的聯繫
- 所有商品名
防護口罩和呼吸器:OSHA
對於旨在用於防止由有害粉塵,煙霧,霧氣和其他有害氣體引起的職業病的呼吸器,OSHA(職業安全)和衛生總署)提供了確定一般規定 呼吸器合規要求的。
29 CFR 1910.134
在 29 CFR 1910.134中,呼吸器應根據不同類別實現最低過濾效率。例如,N95防毒面具應過濾掉至少95%的滲透物,而N99可以過濾掉至少99%的滲透物。
同樣,字母N,P和R表示防油性,如下所示:
- N –不防油
- P –部分防油
- R –防油
NIOSH的要求
42 CFR Part 84 (Subpart K—Non-Powered Air-Purifying Particulate Respirators) 規定了呼吸器設備必須滿足下列的要求才能獲得NIOSH的批准,當中包括但不限於:
- 組件
- 篩檢程式標識
- 篩檢程式效率水準確定
- 氣流阻力測試
- 呼氣閥洩漏測試
- 標記
其他法規
加州法案 65 (CA Prop 65)
加州法案 65旨在限制大多數產品(包括個人防護設備)中有害化學物質的暴露。話雖如此,如果您打算在加利福尼亞州進口和銷售口罩,則應驗證產品中的受限物質,這可以由SGS和TUV等協力廠商公司來完成。
以下是受CA Prop 65限制的某些物質:
- 鉛
- 鎘
- 汞
- 甲醛
風險
某些用於製造口罩和呼吸器的合成材料可能含有過量的受限化學物質和重金屬。
原產國
在美國,必須在進口產品(包括口罩)上貼上原產國標籤。標籤應是永久性的,並在包裝上可見。此外,進口商應指示供應商標籤的位置。
示例
- 中國製造
- 韓國製造
- 美國製造
- 德國製造
產品包裝
除口罩外,在進口到美國時,包裝也受到管制。美國許多州對包裝材料中使用的有害物質設置了限制。接下來是對這些包裝要求的簡要概述。
重金屬限制
包裝材料限制使用鎘,鉛,汞等重金屬。進口商不得在包裝中使用過多的重金屬。實際上,沒有多少供應商可以提供包裝的檢測報告,因此,協力廠商包裝檢測服務是驗證並遵守法規的唯一方法。
標籤要求
對於口罩產品,必須在包裝上提供符合性和產品資訊。進口商應在其包裝上列出所有適用的標準,過濾效率,合格標記和製造商的資訊。
袋窒息警告
袋窒息警告標籤文本對所有亞馬遜賣家和美國某些州都是強制性的。在本文中,我們解釋了有關創建警告標籤文件,風險和違規處罰的必知知識。
亞馬遜示例
警告:為避免窒息的危險,請將此塑膠袋遠離嬰兒和兒童。請勿在嬰兒床,床,馬車或遊戲圍欄中使用此包。這個包不是玩具。
亞馬遜口罩和呼吸器要求
亞馬遜對醫療設備有嚴格的要求。一般而言,供應商應在FDA註冊並由FDA批准在美國銷售的產品。此外,面罩產品必須貼有以下資訊的標籤:
- 製造商信息
- 產品用途
- 用戶說明
- 應用方法